FENÓMENOS BIOFÍSICOS MOLECULARES
Difusion:
Difusión es el intercambio de sustancias de un sitio de
mayor concentración a otro de menor concentración. Mediante el cual la célula
mantiene su integridad estructural y funcional.
El efecto de concentración de soluto en el tiempo de
difusión influyen directamente proporcional en la disolución de tal manera que:
a menor concentración la disolución se hace en menor velocidad y mayor tiempo.
A mayor concentración la disolución se hace en mayor
velocidad y menor tiempo.
El efecto de temperatura en el tiempo de difusión
influyen directamente proporcional en la disolución de tal manera que: a mayor
temperatura, mayor velocidad de difusión menor tiempo.
A menor temperatura, menor velocidad de difusión mayor
tiempo.
Osmosis:
Concretamente, es el paso de moléculas de agua a través de una membrana semipermeable entre dos regiones de diferente concentración.
ADSORCION:
La adsorción es un proceso por el cual átomos, iones o moléculas son atrapados o retenidos en la superficie de un material en contraposición a la absorción, que es un fenómeno de volumen. Es decir es un proceso en el cual un contaminante soluble (adsorbato) es eliminado del agua por contacto con una superficie sólida (adsorbente).
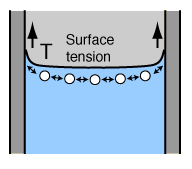
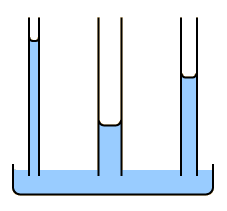
Acción Capilar:
| La acción capilar es el resultado de la adhesión y la tensión superficial. La adhesión del agua a las paredes de un recipiente, originará una fuerza hacia arriba sobre los bordes del líquido y como resultado su ascenso sobre la pared. La tensión superficial, actua para mantener intacta la superficie del líquido, de modo que en vez de solo moverse los bordes hacia arriba, toda la superficie entera del líquido es arrastrada hacia arriba. |